For Educational Purposes Only Not a Substitute for Medical Advice!
Hipertermia maligna adalah penyakit genetik sel otot rangka yang memengaruhi homeostasis kalsium mioplasma.1 Di semua wilayah di dunia, hipertermia maligna (HM) mempengaruhi semua kelompok etnis. Antara 1: 10.000 dan 1:250.000 anestesi, episode HM sering terjadi di bawah anestesi. (2) Ini merupakan tanda respons hipermetabolik nonspesifik yang bisa berakibat fatal jika terapi, termasuk pemberian natrium dantrolene, tidak segera dimulai. Evaluasi yang cepat dan penolakan diagnosis alternatif dapat mengarah pada diagnosis dan pengobatan yang cepat, secara signifikan mengurangi komplikasi seperti gagal ginjal, gagal jantung, koagulasi intravaskular diseminata, dan kematian. Setelah reaksi, pasien harus diobservasi setidaknya selama 24 jam karena kemungkinan kambuh. (3–5) Karena kondisinya bersifat genetik, penyintas dan anggota keluarganya harus dirujuk ke pusat HM khusus untuk pengujian dan konseling lebih lanjut. Risiko kematian akibat HM telah meningkat dalam beberapa tahun terakhir. Ketika dantrolene sodium diperkenalkan untuk mengobati HM, angka kematian turun dari 70-80% menjadi 10%. Baru-baru ini, angka kematian diperkirakan kurang dari 5% ketika episode HM terdeteksi dini dengan kapnografi, dantrolene segera diberikan, dan tes diagnostik dilakukan. Meskipun tingkat kematian HM rendah, morbiditasnya jauh lebih tinggi. Ketika dantrolene sodium diperkenalkan untuk mengobati HM, angka kematian turun dari 70-80% menjadi 10%.6 Baru-baru ini, angka kematian diperkirakan kurang dari 5% ketika episode HM terdeteksi dini dengan kapnografi, dantrolene segera diberikan, dan tes diagnostik dilakukan. Meskipun HM memiliki tingkat kematian yang rendah, ia memiliki morbiditas yang jauh lebih tinggi. (1,2)
Definisi
Hipertermia maligna didefinisikan sebagai reaksi hipertermia progresif yang mengancam jiwa yang terjadi selama anestesi umum. Hipertermia maligna memiliki dasar genetik yang mendasarinya, dan individu yang memiliki predisposisi genetik berisiko mengalami hipertermia maligna saat terpapar anestesi inhalasi atau suxamethonium yang kuat. Ini juga dapat disebut sebagai Sindrom Malignan Hipermetabolik. (2,4) HM terkadang terjadi lebih dari satu jam setelah bangun dari anestesi dan jarang terjadi tanpa paparan patogen yang diketahui. Sebagian besar kasus telah dilaporkan pada laki-laki muda, hampir tidak ada pada bayi dan sedikit pada orang lanjut usia. (3)
Etiologi
Pasien yang secara genetik memiliki predisposisi terhadap penyakit ini dapat mengalami hipertermia maligna sebagai respons terhadap stres, termasuk olahraga berat dan suhu tinggi, dan agen penginduksi seperti suksinilkolin dan/atau gas anestesi terhalogenasi. Meskipun anestesi inhalasi, nitro oksida dan xenon tidak terhalogenasi dan tidak berhubungan dengan hipertermia maligna. (2)
Dalam banyak kasus awal yang dilaporkan, suksinilkolin dan agen anestesi terhalogenasi digunakan dan apa yang disebut kekakuan otot masseter diamati. Namun, suksinilkolin lebih jarang digunakan dalam praktik modern, dan sekitar setengah dari kasus dalam dekade terakhir dikaitkan dengan anestesi volatil sebagai satu-satunya agen pemicu. Apakah suksinilkolin merupakan pemicu tanpa adanya agen volatil sekarang masih kontroversial. Hampir 50% pasien yang mengalami episode HM memiliki setidaknya satu paparan anestesi yang lancar sebelumnya di mana mereka menerima agen pemicu yang diakui. Alasan HM gagal terjadi setelah setiap paparan agen pemicu tidak jelas. Investigasi terhadap penyebab biokimia HM mengungkapkan peningkatan kalsium intraseluler yang tidak terkendali pada otot rangka.
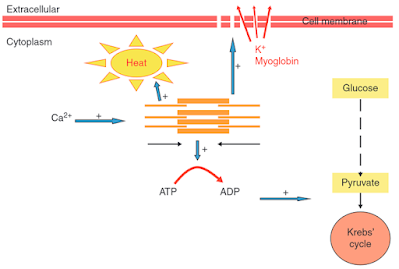
Gambar 1. Hypothesized Overlapping Mechanisms.(7)
Pelepasan tiba-tiba kalsium dari retikulum sarkoplasma menghilangkan penghambatan troponin, menghasilkan kontraksi otot yang berkelanjutan. (3) Gangguan kanal eksitasi-kontraksi adalah mekanisme hipertermia maligna yang menghasilkan peningkatan pelepasan Ion Kalsium dari retikulum sarkoplasma melalui saluran pelepas Ca2+ otot rangka di retikulum sarkoplasma (RyR1) sebagai respons terhadap pemicu. (1)
Gambar 2. Changes During a Malignant Hyperthermia Crisis. (8)
Aktivitas adenosin trifosfatase yang meningkat secara nyata menghasilkan keadaan hipermetabolik yang tidak terkontrol dengan konsumsi oksigen dan produksi CO2 yang meningkat secara signifikan, menghasilkan asidosis laktat dan hipertermia yang parah. Hal ini muncul sebagai krisis hipermetabolik yang berpotensi fatal yang dapat mengakibatkan kerusakan sel otot, hiperkalemia, asidosis, peningkatan serum kreatin kinase (CK), dan mioglobinuria. (9)
Tabel 1. Drugs Known to Trigger Malignant Hyperthermia. (3)
|
Anastesi Umum Inhalasi
|
Depolarizing Muscle Relaxant
|
|
Ether
Halothane
Methoxyflurane
Enflurane
Isoflurane
Desflurane
Sevoflurane
|
Succinylcholine
|
Faktor Risiko
Jika ada riwayat keluarga dengan penyakit genetik yang disebut HMS (Malignant Hyperthermia Susceptibly), risiko berkembangnya penyakit tersebut meningkat. Untuk mendapatkan penyakit ini, hanya satu gen yang diubah yang diwariskan dari induknya (pola pewarisan autosomal dominan). Ada risiko 50% terkena hipertermia maligna (HMS) jika salah satu orang tua memiliki mutasi gen yang menyebabkannya. Risiko HMS meningkat jika pasien memiliki anggota keluarga lain yang melakukannya. Selain itu, semua kondisi berikut ini meningkatkan risiko Anda mengalami hipertermia maligna, seperti adanya peristiwa yang sebelumnya mengarah ke hipertermia maligna selama anestesi atau selama rhabdomyolisis. Mengonsumsi statin dapat merusak jaringan otot atau gangguan dan kelainan otot tertentu yang disebabkan oleh perubahan genetik yang diwariskan. (2)
Patofisiologi
Pengetahuan tentang fisiologi dasar kontraksi otot rangka sangat penting untuk memahami patofisiologi respons HM. Potensial aksi dihasilkan di motor endplate ketika impuls saraf tiba di sambungan neuromuskuler; Asetilkolin kemudian dilepaskan dan berikatan dengan reseptornya. Potensial aksi menyebar ke seluruh membran otot rangka, termasuk invaginasinya, tubulus-T. Di dalam tubulus-T, sensor tegangan yang dikenal sebagai reseptor dihidropiridin (DHPR) mengalami perubahan konformasi sebagai respons terhadap kedatangan potensial aksi. Perubahan konformasi di DPRR melibatkan loop protein intrasitoplasma yang berinteraksi dengan saluran pelepasan kalsium dari retikulum sarkoplasma, isoform dari reseptor ryanodine (RyR). Pori penghantar ion kalsium dari RyR terbuka dan kalsium dilepaskan ke dalam sitosol. Ion kalsium mengikat troponin-C dalam miofilamen tipis, memungkinkan pembentukan jembatan aktin-miosin dan kontraksi otot. Siklus penghubung membutuhkan energi, yang disediakan oleh adenosin trifosfat (ATP). Jembatan aktin-miosin hanya mengubah sekitar 40% energi yang digunakan menjadi kerja, sisanya dihasilkan sebagai panas. Ketika otot berkontraksi, ia menggunakan oksigen dan melepaskan karbon dioksida. Dalam kondisi normal, kalsium secara aktif diasingkan dari sitosol dengan tambahan penggunaan ATP, yang menurunkan konsentrasi kalsium sitosol dan memungkinkan relaksasi otot. (10,11)
Perpindahan energi listrik ke kerja mekanik kontraksi otot dikenal dengan eksitasi-kontraksi multiplikasi (EC). Pada pasien yang sensitif terhadap HM, paparan terhadap pemicu menghasilkan disregulasi pergantian EC dan pelepasan kalsium yang berkelanjutan ke dalam sitosol. Pertama, ini meningkatkan kebutuhan metabolik ATP untuk menyerap kalsium, yang meningkatkan produksi CO2 dan konsumsi O2. Peningkatan CO2 merangsang sistem saraf simpatis dan menyebabkan peningkatan reaktif denyut jantung. Saat pelepasan kalsium terjadi, kapasitas penyerapan terlampaui dan kalsium sitosol yang cukup terakumulasi untuk mengaktifkan miofilamen dan menyebabkan kontraksi otot. Pada fase reaksi ini, produksi panas meningkat dan kekakuan otot progresif berkembang. (10,12)
Gambar 3. Pathophysiology of HM. The effects of increased skeletal muscle cell calcium ion concentration. (10)
Presentasi klinis HM sangat bervariasi, mulai dari program yang dibatalkan dengan gejala ringan hingga sedang hingga krisis HM fulminan dengan hipermetabolisme otot rangka yang parah dan rhabdomyolysis. Tingkat metabolisme yang meningkat juga menghasilkan panas, menghasilkan peningkatan suhu tubuh karena panas dihilangkan oleh otot rangka. Namun, pembentukan panas dipercepat ketika mekanisme kalsium homeostatis dalam sel otot rangka tidak mampu mencegah peningkatan bertahap kalsium intraseluler yang cukup untuk mengaktifkan miofilamen. Aktivitas kontraksi otot tidak efektif (30-60% tergantung jenis seratnya), energi yang dikeluarkan untuk kontraksi meningkatkan panas yang dihasilkan. Aktivitas otot kontraktil selanjutnya meningkatkan kebutuhan akan adenosin trifosfat, tetapi juga menyebabkan tekanan mekanis pada membran otot rangka, yang pertama-tama menyebabkan hilangnya ion kalium dari sel otot dan kemudian ke molekul yang lebih besar, terutama mioglobin dan kreatin kinase. Area kulit yang terbuka mungkin terasa panas, merah dan berkeringat, sedangkan kutil lebih sering terjadi pada anak kecil. (4) Produksi CO2 yang berlebihan dengan peningkatan konsentrasi CO2 selama pernapasan atau hiperventilasi selama pernapasan spontan merupakan indikator awal HM yang sensitif dan spesifik. Sehubungan dengan pemberian suksinilkolin, mungkin terjadi peningkatan nilai CO2 secara tiba-tiba pada akhir respirasi. Gejala awal selanjutnya dari krisis HM mungkin termasuk takikardia, aritmia supraventrikular atau ventrikel, dan kejang gigitan terisolasi atau kekakuan otot umum. 50-80% pasien mengalami aritmia atau reaksi otot. Takikardia sinus nonspesifik dapat dikacaukan dengan anestesi yang tidak adekuat, yang seringkali menunda diagnosis HM. (8,12)
Dari penjelasan di atas dapat dilihat bahwa episode akut reaksi HM meliputi asidosis (pernapasan awal tetapi kemudian bercampur), hiperkalemia, dan aritmia. Koagulopati intravaskular diseminata dapat berkembang sebagai akibat dari suhu tinggi. Rhabdomyolysis masif dikaitkan dengan pembengkakan otot yang menyebabkan sindrom kompartemen, rhabdomyolysis juga dapat menyebabkan penyakit ginjal oklusif akut. (4) Waktu respons HM sangat bervariasi. Reaksi dapat terjadi dalam 10 menit setelah terpapar agen penyebab atau onsetnya dapat tertunda beberapa jam, terutama dengan desfluran. Jalannya reaksi, yang terjadi sekali, bervariasi tergantung pada kecepatan perkembangan, yang biasanya lebih cepat pada reaksi yang terjadi segera setelah pemberian zat pemicu. Reaksi yang lebih mengiritasi biasanya terjadi ketika succametonium dan anestesi inhalasi yang kuat telah diberikan. (3,4)
Sianosis yang khas dapat muncul kemudian pada periode HM, menunjukkan peningkatan konsumsi oksigen. Peningkatan suhu yang cepat (hingga 38,8 °C) adalah tanda yang relatif terlambat. Namun, peningkatan cepat sebesar 0,1°C dalam 15 menit lebih penting secara diagnostik daripada suhu puncak. Dalam beberapa kasus, perubahan suhu tubuh tidak penting, apalagi jika pengobatan yang tepat dimulai tepat waktu. Analisis gas darah arteri menunjukkan kombinasi asidosis respiratorik dan metabolik dengan kelebihan basa negatif, laktemia, hiperkapnia, dan hipoksemia. Krisis pembakaran HM biasanya ditandai dengan PaCO2 0,60 mHMg dan kelebihan basal 0,8 mEq/L. Saat episode HM berlangsung, rhabdomyolysis menyebabkan hiperkalemia, peningkatan creatine phosphokinase, dan mioglobinemia, dan dapat menyebabkan gagal ginjal akut. Tahap akhir krisis HM fulminan ditandai dengan kegagalan multiorgan dan kolaps sirkulasi. (5,8)
Tabel 2. Manifestasi Klinis Hipertermia Maligna
Saat ini, hanya sebagian kecil pasien dengan hipertermia maligna (HM) yang dilaporkan terkait dengan respons HM yang muncul, yang dimanifestasikan oleh spektrum penuh gejala HM yang meningkat secara klinis (hiperkarbia, takikardia, hipertermia, asidosis, dan kekakuan otot). Timbulnya gejala klinis pertama sering tertunda dan lebih berbahaya pada kasus HM yang baru didokumentasikan. Banyak dari pasien ini, kemudian diidentifikasi sebagai rentan terhadap HM, menunjukkan resolusi gejala setelah penghentian anestesi penyebab tetapi sebelum pemberian dantrolene. (2)
Tanda dan gejala, observasi selama dan segera setelah anestesi, dan tes darah untuk mengidentifikasi komplikasi digunakan untuk mendiagnosis hipertermia maligna. Gejala peringatan dini hipertermia maligna adalah peningkatan denyut jantung (takikardia) yang tidak dapat dijelaskan. Peningkatan tak terduga dalam jumlah karbon dioksida yang diproduksi oleh tubuh, takipnea (pernapasan cepat), kekakuan otot, dan peningkatan suhu yang cepat. Fitur diagnostik selanjutnya dari hipertermia maligna termasuk urin berwarna gelap, peningkatan suhu tubuh yang berhubungan dengan demam (hipertermia), tes darah menunjukkan kerusakan otot, irama jantung abnormal, perdarahan, dan kejang. (2,13,14)
Berikut tanda-tanda awal hipertensi maligna: (1,15)
- Kekakuan otot dan/atau kekakuan umum setelah pemberian suksinilkolin.
- Hiperkapnia yang tidak tepat meskipun peningkatan menit ventilasi atau takipnea terkait dengan pernapasan spontan pasien dan peningkatan tekanan parsial CO2 darah arteri di atas 60 mHMg. Peningkatan karbon dioksida dapat terjadi secara bertahap dan dapat dikompensasi dengan peningkatan ventilasi semenit yang berulang.
- Sinus takikardia diikuti respon HM lebih besar dari 80% akibat aritmia jantung dan tekanan darah tidak stabil. Tanda ini dapat dikacaukan dengan anestesi yang tidak adekuat dan seringkali hanya dikenali sebagai tanda HM setelah terjadi. Takikardia dapat diamati pada pasien yang menerima beta-blocker atau remifentanil.
- Peningkatan suhu tubuh mungkin merupakan tanda pertama atau ketiga yang dilaporkan pada 63,5% reaksi HM, menunjukkan pentingnya pemantauan suhu tubuh. Bukan suhu puncak yang penting secara diagnostik, tetapi laju kenaikan suhu, yang bisa mencapai 1-2°C setiap lima menit.
Skala Penilaian Klinis
Skala penilaian klinis yang dikembangkan oleh Larach et al. (16) menggunakan proses Delphic berulang untuk memfasilitasi diagnosis klinis. Item skala diberikan pada Tabel 1. Bobot yang berbeda diberikan untuk setiap manifestasi sindrom. Namun, skalanya kurang sensitif, karena tidak semua tes dapat diselesaikan dalam sekali episode. (9)
Setiap proses diberi bobot dan skor menurut kepentingannya untuk membedakan HM dari penyebab lain perubahan proses fisiologis. Hanya satu elemen dalam setiap proses yang harus ada untuk diperhatikan. Skor kemudian dibuat untuk menilai kemungkinan bahwa episode tersebut adalah episode HM, dalam skala dari hampir tidak pernah hingga hampir pasti. Karena ini adalah ukuran klinis dan bergantung pada ketersediaan tes laboratorium, nilainya terutama dalam mengidentifikasi individu dengan episode HM yang paling menonjol untuk penilaian sensitivitas dan spesifisitas tes diagnostik selanjutnya. (9)
Pemeriksaan Laboratorium
Gold standard saat ini untuk diagnosis HM adalah tes kontraktur in vitro berdasarkan kontraksi serat otot dengan adanya halotan atau kafein. Dua bentuk tes yang banyak digunakan ini telah dikembangkan, yakni In Vitro Contracture Test (IVCT) oleh European Malignant Hyperthermia Group (EHMG) dan yang lainnya adalah Caffeine Halothane Contracture Test (CHCT) oleh North American Malignant Hyperthermia Group (NAHMG). Jika menggunakan protokol EHMG, seseorang dianggap rentan terhadap HM (Malignant hyperthermia susceptible) jika hasil tes kafein dan halotan keduanya positif. Seseorang dianggap tidak rentan terhadap HM (Not susceptible to Malignant hyperthermia) jika kedua tes negatif. Seseorang juga didiagnosis dengan HMS jika hasil tesnya positif untuk halotan atau kafein saja dan orang-orang ini disebut HMS(h) atau HMS(c). Protokol EHMG melaporkan sensitivitas 99% dengan spesifisitas 94%, sedangkan protokol NAHMG melaporkan spesifisitas 97%, memberikan kepercayaan pada hasil yang diperoleh. Spesifisitas dari kedua protokol dapat dikompromikan oleh penyakit neuromuskuler terkait non-HM yang terkait dengan peningkatan konsentrasi Ca2+ mioplasma. Studi berdasarkan hasil dari kembar identik menunjukkan bahwa IVCT memiliki reproduktifitas yang wajar. Varian ketiga IVCT, tes serat kulit kafein, tampaknya tidak digunakan secara diagnostik di luar Jepang dan memiliki spesifisitas dan sensitivitas yang lebih rendah daripada protokol EHMG atau NAHMG. (5,9)
Uji kerentanan. Jika terdapat faktor risiko, pengujian dapat direkomendasikan untuk menentukan apakah pasien berisiko tinggi mengalami hipertermia maligna (tes kerentanan). Tes mungkin termasuk biopsi otot atau analisis genetik. (4)
Biopsi otot (tes kontraktur). Dalam beberapa situasi, ketika pasien berisiko mengalami hipertermia maligna, dokter mungkin akan melakukan tes otot. Sepotong kecil jaringan otot diangkat dengan operasi dan dikirim ke laboratorium untuk diperiksa. Untuk menilai kontraksi otot, sampel laboratorium diperlakukan dengan zat yang menyebabkan hipertermia maligna. Kunjungan ke fasilitas biopsi otot khusus diperlukan karena tes ini harus dilakukan segera setelah jaringan otot diangkat. (4)
Analisis Genetik. Pengujian genetik mengidentifikasi perubahan gen (mutasi) yang merupakan predisposisi hipertermia maligna. Darah diambil, sampel diambil dan dikirim ke laboratorium untuk evaluasi. Perubahan genetik yang menunjukkan kondisi bawaan yang dikenal sebagai kerentanan terhadap hipertermia maligna (HMS) dapat ditemukan melalui pengujian genetik. (4)
Gambar 4. Alur Penegakan Hipertermia Maligna. (17)
Tes laboratorium lainnya biasanya menunjukkan asidosis metabolik dan respiratorik campuran dengan defisit basa yang nyata, hiperkalemia, hipermagnesemia, dan penurunan saturasi oksigen vena campuran. Beberapa laporan kasus menggambarkan asidosis respiratorik terisolasi di awal episode HM. Konsentrasi kalsium terionisasi serum bervariasi. Ini mungkin pertama meningkat dan kemudian menurun. Kadar serum mioglobin, kreatin kinase (CK), laktat dehidrogenase, dan aldolase serum pasien biasanya meningkat. Jika puncak CK serum (maksimum biasanya diukur 12-18 jam setelah anestesi) melebihi 20.000 IU/L, diagnosis sangat dicurigai. Perlu dicatat bahwa pemberian suksinilkolin pada beberapa pasien normal tanpa HM dapat menyebabkan peningkatan kadar mioglobin serum dan CK yang nyata. (3,5)
Tabel 3. Skala Penilaian Klinis Hipertermia Maligna. (16)
Tabel 4. Signifikansi klinis skor hipertermia maligna dan peringkatnya. (16)
Penatalaksanaan
Hipertermia Maligna Akut
Tujuan pengobatan adalah pemberian dantrolene secara cepat, pendinginan hingga suhu target tidak lebih dari 38,5 °C, hiperventilasi dan tindakan suportif: (1,18)
- Jika Anda mencurigai HM untuk pertama kalinya, hentikan penggunaan pemicu (anestesi inhalasi yang mudah menguap dan suksinilkolin). Hapus evaporator. Jika pembedahan tidak dapat dihentikan, anestesi harus diubah menjadi induksi dengan teknik anestesi intravena penuh.
- Laporkan keadaan darurat dan minta bantuan - diperlukan lebih banyak staf untuk menghindari keterlambatan pengobatan dan komplikasi.
- Untuk menormalkan CO2 pernapasan, lakukan hiperventilasi dengan oksigen 100% pada aliran gas tinggi, minimal 10 L/menit. Filter karbon aktif dapat ditempatkan di bagian inspirasi dan ekspirasi dari siklus pernapasan untuk segera mengurangi konsentrasi anestesi ke tingkat minimum. Jika tidak, sirkuit yang bersih dapat digunakan jika terdapat cukup personel untuk tidak menunda prioritas pemeliharaan lainnya.
- Berikan dantrolene sodium 2,5 mg/hari. Berikan bolus pertama secara intravena dengan cepat dan lanjutkan dosis dantrolene setiap 5 hingga 10 menit sampai gejala HM (hiperkarbia, kekakuan, takikardia, dan suhu tinggi) terkontrol dan sistem kardiorespirasi stabil. Dantrolene harus dimulai dengan dosis 2,5 mg/kg dan jika ada respons, penggunaan harus dilanjutkan dengan dosis tersebut sampai hipermetabolisme terkoreksi. Dosis dantrolene dapat ditingkatkan jika tidak ada tanda-tanda reaksi. Dosis maksimum yang dianjurkan adalah 10 mg/kg bila bolus dantrolene dosis rendah tidak berpengaruh sama sekali. Perhatikan bahwa diagnosis banding harus dievaluasi kembali jika suhu tinggi, kekakuan otot dan asidosis tidak membaik setelah pemberian dantrolen 10 mg/kg. Jika HM masih dianggap sebagai kemungkinan diagnosis, tambahkan dantrolene, walaupun dantrolene mungkin tidak efektif pada nekrosis otot yang parah dan lebih banyak perhatian harus diberikan pada pendinginan tubuh (lihat di bawah). Setiap vial dantrolene sodium mengandung 20 mg dantrolene dan 3 g manitol. Satu botol harus dicampur dengan 60 ml air steril untuk injeksi. Setidaknya 12 vial dantrolene per 80 kg pasien harus segera tersedia untuk terapi awal. Cukup 2,5 mg/kg dantrolene Minimal 36 vial mungkin diperlukan untuk merawat pasien dewasa. Bentuk natrium dantrolene yang lebih pekat, Ryanodex mengandung 250mg di setiap botol dan membutuhkan 5ml air steril untuk dilarutkan.
Lanjutkan pemantauan anestesi rutin, termasuk EKG, tekanan darah noninvasif, saturasi oksigen, dan end-tidal CO2 (ETCO2). Mulailah memantau suhu inti Anda jika Anda belum melakukannya. Periksa gas darah arteri atau vena (tanpa torniket), kalium serum, laktat, CK (peningkatan CK mungkin tidak terdeteksi selama beberapa jam), mioglobin serum dan urin, keluaran urin, fungsi tiroid, kultur darah dan profil koagulasi, periksa kadar glukosa setiap jam saat pemberian insulin. (1)
Atasi hipertermia saat suhu mencapai 39°C atau naik dengan cepat dengan mendinginkan permukaan dengan seprai basah, dingin, kipas, dan kompres es di ketiak dan selangkangan. Berikan kristaloid isotonik intravena dingin atau dingin. Hentikan pendinginan saat suhu turun di bawah 38,5°C. Hiperkalemia harus diterapi dengan bikarbonat (untuk keadaan asidosis) dan/atau glukosa dan insulin intravena (misalnya, 10 unit insulin reguler dalam 50 ml glukosa 50% yang dititrasi untuk kadar kalium). Aritmia yang mengancam jiwa akibat hiperkalemia harus diobati dengan 10 sampai 30 mg/kg kalsium klorida intravena. Aritmia biasanya merespons pengobatan asidosis dan hiperkalemia; jika berkepanjangan, obat antiaritmia standar dapat digunakan (misalnya, amiodaron, 150 sampai 300 mg untuk orang dewasa). Jangan gunakan penghambat saluran kalsium dengan dantrolen karena dapat menyebabkan hiperkalemia yang fatal dan kolaps sirkulasi. Namun, jika pasien secara kronis menggunakan penghambat saluran kalsium sebelum operasi dan mengembangkan reaksi HM, penggunaan dantrolene tidak boleh dihentikan. (1)
Untuk mencegah gagal ginjal akut, pertahankan keluaran urin di atas 2 mL/Kg/Jam dengan rehidrasi dan/atau penggunaan manitol atau furosemid. Ingatlah bahwa setiap vial natrium dantrolene mengandung 3 gRAM manitol dan hipovolemia yang diinduksi diuretik harus dihindari. (1)
Manajemen Post Reaksi Hipertermia Maligna
Pada pasien post reaksi, lakukan pemantauan pasien di unit perawatan intensif setidaknya selama 24 jam. Kekambuhan reaksi HM dapat terjadi hingga 25% dari pasien30 dan mungkin memerlukan perawatan lebih lanjut. HMAUS merekomendasikan dosis bolus dantrolene sodium 1 mg kg-1 iv setiap enam jam selama setidaknya 24 jam atau lebih lama sesuai kebutuhan klinis. Pemberian dantrolen dapat diinterupsi atau interval pemberian dosis ditingkatkan menjadi setiap 8 jam atau setiap 12 jam jika suhu jantung >38°C dan CK turun, otot tidak kaku, dan tidak ada tanda mioglobinuria dan stabilitas metabolik selama 24 jam. Pantau gas darah arteri, CK serum, kalium dan kalsium, mioglobin urin dan serum, dan faktor koagulasi setiap enam jam sampai nilai normal kembali, dan obati sesuai kebutuhan. Suhu inti harus terus dipantau sampai stabil.(1,19)
Manajemen Pada Pasien Susceptible Hipertermia Maligna
Berikut penatalaksanaan pasien dengan susceptible hipertermia maligna: (1,3,20)
- Periode sebelum operasi. Pasang mesin anestesi yang bersih dan bebas asap sesuai dengan instruksi pabriknya. Keluarkan vial suksinilkolin dan alat penguap dari ruang operasi. Filter karbon aktif dapat digunakan untuk mempercepat persiapan mesin anestesi. Disebutkan secara khusus sensitivitas HM pasien selama periode istirahat pra operasi dianjurkan.
- Periode interoperasi. Pemantauan standar dan pemantauan suhu internal berkelanjutan harus digunakan.
- Fase pasca operasi. Pasien yang sensitif terhadap HM tidak perlu lagi tinggal di ruang pemulihan atau di rumah sakit karena tidak ada risiko reaksi HM saat pasien ini menerima anestesi terbuka.
Komplikasi
Jika tidak diobati, hipermetabolisme yang tidak terkontrol disertai dengan hipertermia berat (suhu inti 41°C) menyebabkan konsumsi simpanan energi dan adenosin trifosfat yang cepat dan menyebabkan asidosis respiratorik dan kemudian metabolik dan disfungsi organ vital yang meluas, edema serebral, dan koma. Kerusakan otot rangka, rhabdomyolysis, dibuktikan dengan peningkatan dramatis konsentrasi CK serum, menyebabkan hiperkalemia yang mengancam jiwa (aritmia jantung parah dan serangan jantung), mioglobinuria (gagal ginjal akut) yang dimanifestasikan oleh urin berwarna cola, dan DIC. Komplikasi yang paling umum dilaporkan sebagai disfungsi ginjal dan jantung. (1,21)
Kesimpulan
Malignant hyperthermia (HM) adalah kelainan farmakogenetik otot rangka yang bermanifestasi sebagai respons hipermetabolik terhadap gas anestesi volatil yang kuat seperti halotan, sevofluran, desfluran, isofluran, dan relaksan otot depolarisasi suksinilkolin, dan jarang pada manusia terhadap stresor seperti stresor berat dan panas. Frekuensi reaksi HM bervariasi dari 1:10.000 banding 1:250.000 anestesi. Namun, prevalensi kelainan genetik bisa setinggi satu dari 400 orang. Tanda klasik HM termasuk hipertermia, takikardia, takipnea, peningkatan produksi karbon dioksida, peningkatan konsumsi oksigen, asidosis, hiperkalemia, kekakuan otot, dan rhabdomyolysis, semuanya terkait dengan respons hipermetabolik.
Sindrom ini biasanya berakibat fatal jika tidak ditangani. Peningkatan karbon dioksida pada akhir jeda pernafasan meskipun peningkatan menit ventilasi memberikan petunjuk diagnostik awal. Pada manusia, sindrom ini diwariskan secara autosomal dominan, sedangkan pada babi diwariskan secara autosomal resesif. Peningkatan kalsium mioplasma yang tidak terkendali, yang mengaktifkan proses biokimia yang berhubungan dengan aktivasi otot, menyebabkan perubahan patofisiologis.
Deteksi dan pengobatan dini penting untuk pengobatan yang efektif. Onsetnya bisa beberapa menit setelah induksi atau berbahaya. Gejala awal hipertermia maligna (HM) seringkali tidak spesifik, yang dapat membuat diagnosis menjadi sangat sulit.
Daftar Pustaka
- Riazi S, Kraeva N, Hopkins PM. Updated guide for the management of malignant hyperthermia. Can J Anesth Can Anesth. 2018 Jun;65(6):709–21.
- Bahaidarah F, Hassan Gharamah Mohammed Alasmari, Ali Adnan Alkhamis, Ali Ibrahim Alshaqaqiq, Faisal Abdulrahman Hassan Alasmari, Yousef Abdulmohsen Ali Alrashed, et al. Emergent Management of Malignant Hyperthermia: Review article. Saudi Med Horiz J. 2022 Dec 24;3(1):36–40.
- Morgan GE, Mikhail MS. Morgan & Mikhail’s clinical anesthesiology. Sixth edition. Butterworth JF, Mackey DC, Wasnick JD, editors. New York: McGraw-Hill Education; 2018.
- Hopkins PM, Girard T, Dalay S, Jenkins B, Thacker A, Patteril M, et al. Malignant hyperthermia 2020: Guideline from the Association of Anaesthetists. Anaesthesia. 2021 May;76(5):655–64.
- Malignant Hyperthermia - Injuries; Poisoning [Internet]. MSD Manual Professional Edition. [cited 2023 Apr 17]. Available from: https://www.msdmanuals.com/en-in/professional/injuries-poisoning/heat-illness/malignant-hyperthermia
- Lapisatepun W, Arkarattanakul S. Early Recognition and Treatment of Malignant Hyperthermia in Pediatric Patient during Bronchoscopy. Case Rep Anesthesiol. 2020 Feb 22;2020:1–3.
- Laitano O, Murray KO, Leon LR. Overlapping Mechanisms of Exertional Heat Stroke and Malignant Hyperthermia: Evidence vs. Conjecture. Sports Med. 2020 Sep;50(9):1581–92.
- Schuster F, Roewer N, Schneiderbanger D, Johannsen S. Management of malignant hyperthermia: diagnosis and treatment. Ther Clin Risk Manag. 2014 May;355.
- Rosenberg H, Pollock N, Schiemann A, Bulger T, Stowell K. Malignant hyperthermia: a review. Orphanet J Rare Dis. 2015 Dec;10(1):93.
- Gupta PK, Hopkins PM. Diagnosis and management of malignant hyperthermia. BJA Educ. 2017 Jul;17(7):249–54.
- Yang L, Tautz T, Zhang S, Fomina A, Liu H. The current status of malignant hyperthermia. J Biomed Res. 2020;34(2):75.
- Kim JH, Lee CK, Chung CE, Min BD, Kim DC. Malignant hyperthermia: a case report with a literature review. Arch Aesthetic Plast Surg. 2022 Apr 30;28(2):75–8.
- Watt S, McAllister R. Malignant Hyperthermia. StatPearls [Internet]. 2023 Jan 16 [cited 2023 Apr 18]; Available from: https://www.statpearls.com/ArticleLibrary/viewarticle/24676
- Review IJ of R and. A Review on Malignant Hyperthermia. Int J Res Rev [Internet]. 2022 [cited 2023 Apr 18];9(12). Available from: https://www.ijrrjournal.com/IJRR_Vol.9_Issue.12_Dec2022/IJRR-Abstract27.html
- Iqbal A, Badoo S, Naqeeb R. A case report of suspected malignant hyperthermia where patient survived the episode. Saudi J Anaesth. 2017;11(2):232.
- Larach MG, Localio AR, Allen GC, Denborough MA, Ellis FR, Gronert GA, et al. A Clinical Grading Scale to Predict Malignant Hyperthermia Susceptibility. Anesthesiology. 1994 Apr 1;80(4):771–9.
- Testing for MH [Internet]. European Malignant Hyperthermia Group. 2015 [cited 2023 Apr 18]. Available from: https://www.emhg.org/testing-for-mh
- Malignant Hyperthermia in the Operating Room: Practice Essentials, Problem, Management [Internet]. [cited 2023 Apr 18]. Available from: https://emedicine.medscape.com/article/2500077-overview
- Ebbitt L, Johnson E, Herndon B, Karrick K, Johnson A. Suspected Malignant Hyperthermia and the Application of a Multidisciplinary Response. Healthcare. 2020 Sep 9;8(3):328.
- Malignant Hyperthermia: Background, Pathophysiology, Etiology [Internet]. [cited 2023 Apr 18]. Available from: https://emedicine.medscape.com/article/2231150-overview
- Mullins MF. Malignant Hyperthermia: A Review. J Perianesth Nurs. 2018 Oct;33(5):582–9.
Keywords: Makalah Hipertermia Maligna, Refarat Hipertermia Maligna, Referat Hipertermia Maligna, Hipertermia Maligna, Hipertermia, Maligna
Respect Copyrights: Cite this website as source. Thank You!
Artikel Terkait:













0 Comments